Diálisis: método en el cual se usa una membrana porosa (o de diálisis) que tiene poros de tamaño tal que las macromoléculas y las proteínas no puedan pasar, en cambio todo lo pequeño, como iones de sales si lo hagan. El límite esta en un PM= 12000 de ahí para arriba no pasa nada. Con este método uno separa proteínas de azúcares, de sales, etc.
 La membrana de diálisis que estará con una solución de proteínas mas sales, las cuales se pretenden eliminar, se deja agitando por 4 horas aproximadamente, para que las moléculas pequeñas se queden en el tampón. Hasta q quede igualmente distribuido, que haya la misma concentración de sales adentro (membrana de diálisis) y afuera (tampón). Y luego se va cambiando el tampón (por uno sin sales) entonces este método se usa para desalar y también se usa para cambiarle el tampón a una solución de proteínas (para pasar de un tampón a otro) y en medicina los enfermos renales se dializan, para limpiar la sangre ya que el riñón no puede hacerlo, eliminando compuestos tóxicos, que pasaran a un suero fisiológico y la sangre quedará pura.
La membrana de diálisis que estará con una solución de proteínas mas sales, las cuales se pretenden eliminar, se deja agitando por 4 horas aproximadamente, para que las moléculas pequeñas se queden en el tampón. Hasta q quede igualmente distribuido, que haya la misma concentración de sales adentro (membrana de diálisis) y afuera (tampón). Y luego se va cambiando el tampón (por uno sin sales) entonces este método se usa para desalar y también se usa para cambiarle el tampón a una solución de proteínas (para pasar de un tampón a otro) y en medicina los enfermos renales se dializan, para limpiar la sangre ya que el riñón no puede hacerlo, eliminando compuestos tóxicos, que pasaran a un suero fisiológico y la sangre quedará pura.De acuerdo a esta tabla de purificación un proceso de diálisis se podría hacer después de la etapa 2 o sea después de la precipitación con sulfato de amonio para eliminar las sales de sulfato.
El paso 3 es cromatografía de intercambio iónico, donde hay una columna de intercambio iónico donde ciertas proteínas quedan retenidas, las que tienen cargas opuestas al intercambiador y después para eluir las proteínas de la columna ahí es donde se produce la separación, de todos los que están retenidos algunos eluyen primero que otros. La elución se hace como es un intercambio iónico, los que están unidos son iones y así son desplazados de la columna, los intercambiadores tendrán carga positiva y otros negativa dependiendo de la proteína, si esta tiene carga neta positiva el intercambiador tendrá carga negativa. Para eluir esto se puede introducir un cambio de pH para que cambie la carga neta, pero no es muy práctico más fácil y practico es agregar NaCl al tampón en un gradiente escalonado o lineal, entonces el NaCl (catión Na+ y anión Cl) en este caso el Na va a ser que la proteína (con carga negativa) se desplace por la columna. Si hay suficiente concentración de Na y se agrega en aumento unas van a eluir primero las que estén más débilmente unidas y así. Eluyen separadas unas tras otras. Y después para sacar esa solución de NaCl se hace por diálisis.
Analizador de aminoácidos: separación por cromatografía de intercambio iónico o se usa una columna de HPLC de fase reversa (eso significa que se separa por polaridad, los polares eluyen primero).
Ejemplos de ensayos de actividad enzimática
La enzima FBPasa regula la gluconeogénesis, hidroliza un enlace según la reacción:
Fructosa 1.6 difosfato flecha fructosa 6 fosfato +fosfato + H2O (hidrólisis)
Esta enzima usa Mg como cofactor.
Para determinar su actividad catalítica se usan 2 ensayos:
1º Ensayo de actividad de FBPasa, de tiempo fijo: uno determina la aparición de fosfato libre, porque la enzima específicamente hidroliza el fosfato de la posición 1 y el otro queda unido en la posición 6 de la fructosa, entonces se libera fosfato. El ensayo de tiempo fijo comprende un medio de reacción que tiene tampón CH3Cl de pH 7.5 (optimo), contiene sulfato de mg para tener cofactor también tiene sustrato de concentración alta (ojala saturante) porque se mide la velocidad máxima Tº a 35º la reacción se inicia cuando se agrega la enzima Tiempo de reacción 5 minutos y se detiene agregando un reactivo que contiene H2SO4 concentrado.
2º Ensayo de actividad de FBPasa cinético, (o continuo) usando reacciones acopladas: Se mide mientras ocurre la reacción catalizada por la enzima (diferente al de tiempo fijo) donde existen 2 opciones la reacción puede ocurrir en una cubeta de un espectrofotómetro o en un espectroflurimetro donde se mide fluorescencia. Mientras ocurre la reacción se mide la aparición de la absorbancia de un producto o la desaparición de absorbancia o fluorescencia de un sustrato. En esta reacción se forma fructosa 6 fosfato y fosfato libre, los azucares y azucares fosforilados no absorben ni UV ni visible por eso se usan reacción acopladas eso significa q en el medio de reacción agrego otras enzimas ( aparte del cofactor y del sustrato) las enzimas auxiliares, son 2 en este caso una de ellas cataliza la isomerización de fructosa 6 fosfato a glucosa 6 fosfato es una fosfoglucosa isomerasa entonces apenas se forma fructosa 6 fosfato por efecto de esta enzima que está presente en alta concentración mucha actividad catalítica se forma glucosa 6 fosfato además hay una segunda enzima que cataliza la reacción donde la glucosa 6 fosfato se oxida y aquí como cofactor de oxido reducción como coenzima usa NAD, le transfiere electrones al NAD y se forma en NADH. El sistema NAD/NADH es muy útil, el NADH tiene un máximo de absorbancia a 340 nm y el NAD no absorbe a esa longitud de onda. Entonces lo q se mide es la aparición de absorbancia del NADH en función del tiempo ese es el ensayo cinético con reacción acopladas porque la reacción misma que cataliza la enzima no genera directamente algo que se pueda medir como la absorbancia pero como las 2 enzima auxiliares están en alta concentración, lo que limita la velocidad de reacción es la enzima que uno quiere medir.
Ventajas de este ensayo sobre el de tiempo fijo es que en el 1º uno está directamente observando la proceso ve si hay un cambio lineal, etc.
Aplicación práctica de ensayos de la actividad catalítica por ejemplo en la determinación de actividad enzimática en el suero de la sangre (ensayo de laboratorio clínico). Muchos estados patológicos afectan la concentración de enzimas en el plasma.
Si una persona tiene hepatitis el tejido de hígado está irritado entonces algunas células inflamadas se rompen y empiezan a salir a la sangre enzimas propias del hígado y esas se pueden detectar en el suero del paciente. Si lo que está afectado es de otro órgano lo que se encuentran serán enzimas de ese otro órgano. Se determina a través de su actividad catalítica ahí basta una baja concentración ya que es un método especifico, no importa si hay mas proteínas porque detecta la actividad catalítica.
Enzimas de importancia en el diagnostico:
· Fosfatasa alcalina (enfermedad hepática u o sea): enzima presente en hígado y huesos tiene un pH óptimo alcalino, para corroborar hepatitis.
· Fosfatasa acida (carcinoma de próstata). pH optimo acido permite diagnosticar carcinoma de próstata.
· Alanina aminotransferasa (lesión hepática) también del hígado,
· Aspartato aminotransferasa (lesión hepática o muscular, infarto) aparece después de un infarto al miocardio
· Creatina quinasa (lesión muscular, infarto) proviene de musculo esquelético o cardiaco.
· Alfa amilasa (pancreatitis aguda)
· Lactato deshidrogenasa (lesión muscular, infarto)
Siempre se produce un aumento de la actividad enzimática en el suero en el estado patológico, porque se sabe el nivel normal de las enzimas.
Como ejemplo las enzimas marcadoras de un infarto al miocardio: primero aparece la creatina quinasa (CK), luego la aspartato aminotransferasa (AST) y por último la lactato deshidrogenasa (LDH).
En un ensayo de actividad enzimática uno determina la actividad catalítica sin embargo existen para algunas enzimas diferentes isoenzimas son enzimas diferentes que catalizan la misma reacción y este término es para la misma especie por ejemplo de humanos existen diferentes isoenzimas de la LDH, la LDH de humano no es isoenzimas respecto de LDH de perro.
Se diferencian:
· peso molecular (y secuencia, son de diferentes genes)
· Estructura cuaternaria
· Propiedades catalíticas, catalizan la misma reacción pero tienen diferentes Km.
· Propiedades regulatorias
Ejemplo clásico es el de la LDH, dependiendo del órgano en que se encuentre su propiedad será diferentes, las bisoñez presentan una localización celular o sub celular diferente pero del mismo organismo, o sea, en un tejido predomina una isoenzima y en otro predomina otra. por ejemplo de la FBPasa existe una isoforma muscular y otra hepática que esta en el riñón, Y son muy diferentes sus propiedades regulatorias, por lo tanto si uno quiere estudiar la actividad catalítica también tiene que determinar de cual isoenzima se trata y ahí se puede usar electroforesis.
Ejemplos de isoenzima:
· hexoquinasa
· Hexoquinasa muscular y hepática (glucoquinasa)
· Lactato deshidrogenasa (LDH)
· 5 isoenzimas: A4, A3B, A2B2, AB3 y B4 (musculo cardiaco: B4)
· Aldolasa: una A y una B
· FBPasa: una hepática y una muscular
Otra aplicación es que ciertos metabólitos se determinan por ensayos enzimáticos, ejemplo determinación de:
Glucosa: donde el método de referencia usa hexoquinasa y glucosa 6 fosfato deshidrogenasa.
Colesterol: el método CHOD PAP usa 3 enzimas (como el colesterol no absorbe ay que transformarlo en otra cosa que si absorba, por eso se usan estos ensayos)
Inhibición de la Actividad Enzimática
Se habla de inhibición cuando la actividad enzimática es menor, y la velocidad es baja.
Donde encontramos: inhibición irreversible y reversible
Ejemplo de inhibición irreversible:
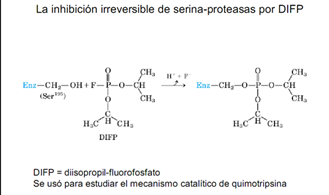 Mecanismo catalítico de quimotripsina que tiene una serina esencial es un mecanismo con catálisis covalente, esta serina reacciona con el DIFP, se forma un compuesto se establece un enlace covalente entre el grupo de la serina y el compuesto y esto es irreversible, entonces todas las moléculas de la enzima que reaccionaron con el compuesto ya no pueden catalizar la reacción porque su serina esta modificada químicamente. Este proceso es la causa de toxicidad, los gases tóxicos inhiben la acetilcolinesterasa enzima indispensable para transmisión de impulso nervioso. Se usa para generar antibióticos o fungicidas.
Mecanismo catalítico de quimotripsina que tiene una serina esencial es un mecanismo con catálisis covalente, esta serina reacciona con el DIFP, se forma un compuesto se establece un enlace covalente entre el grupo de la serina y el compuesto y esto es irreversible, entonces todas las moléculas de la enzima que reaccionaron con el compuesto ya no pueden catalizar la reacción porque su serina esta modificada químicamente. Este proceso es la causa de toxicidad, los gases tóxicos inhiben la acetilcolinesterasa enzima indispensable para transmisión de impulso nervioso. Se usa para generar antibióticos o fungicidas.La inhibición reversible es más estudiada y se clasifica en varios tipos:
 1º La enzima se une al sustrato o al inhibidor, se compite por el sitio activo. Entonces todas las moleculas de enzima que están unidas al inhibidor no catalizan. Es por eso q en presencia del inhibidor baja la velocidad de reacción y no se forma producto.
1º La enzima se une al sustrato o al inhibidor, se compite por el sitio activo. Entonces todas las moleculas de enzima que están unidas al inhibidor no catalizan. Es por eso q en presencia del inhibidor baja la velocidad de reacción y no se forma producto. 1. El succinato y el malonato se asemejan estructuralmente ambos son ácidos. bicarboxilicos, pero la reacción del succinato deshidrogenasa se forma un doble enlace entre los 2 CH2 lo que el malonato o puede hacer, entonces el malonato solo compite.
1. El succinato y el malonato se asemejan estructuralmente ambos son ácidos. bicarboxilicos, pero la reacción del succinato deshidrogenasa se forma un doble enlace entre los 2 CH2 lo que el malonato o puede hacer, entonces el malonato solo compite.2. esto puede ocurrir en el metabolismo si se acumula producto, este puede ser parecido al sustrato entonces inhibe a la enzima.
3. esto se usa cuando una persona llega con intoxicación por metanol, este es dañino pero no tanto como el aldehído fórmico (formaldehido) que es letal, que se forma por deshidrogenacion del metanol la enzima que cataliza esta transformación es la alcohol deshidrogenasa. entonces a la persona se le administra etanol en cantidades controladas entonces el etanol compite con el metanol, si se les da más etanol este es el que gana y por acción de la enzima sobre el etanol se forma acetaldehído que no es tan toxico como el formaldehido. Este ejemplo también se trata de sustratos alternativos no es solamente un inhibidor sino que la enzima une este otro compuesto y cataliza la reacción.
Entonces para que exista competencia debe a ver un parecido estructural.
2º El sustrato se une a un sitio activo se forma el complejo ES y el inhibidor se une a otro sitio pero después de la formación ES. y cuando I esta unido a E a pesar de la unión de S la rección ocurre a una menor velocidad porque I produce un cambio conformacional de la molécula de enzima. Por eso disminuye la actividad catalítica y es reversible.
3º En la mixta tenemos situación parecida a la incompetitiva, pero tiene sus diferencias, parecida porque hay unión de S a E en un sitio diferente de I a E, entonces no compiten por el sitio activo, pero la diferencia es que el I puede unirse a la enzima libre o cuando ya está formado el complejo ES, y la velocidad de reacción es lenta.
La diferencia entre mixta y no competitiva es que si I afecta el Km la inhibición es MIXTA, y si el I no afecta el Km la inhibición es NO COMPETITIVA.
Para determinar si el I es de tipo competitivo, no competitivo, incompetitivo o mixta se hacen estudios cinéticos. Y se grafica con dobles recíprocos:
1º Se mide La velocidad de reacción en función de la concentración de sustrato, 1º sin agregar inhibidor se obtiene velocidad de reacción a diferente concentración de sustrato, 2º se agrega un acierta concentración de inhibidor y se mide velocidad de reacción 3º y luego se agrega mayor concentración de inhibidor y se vuelve a medir. Lo que tenemos de resultado al graficar los recíprocos es que todas las rectas cortan al eje y en un mismo punto pero en el eje x cortan en diferentes puntos formándose diferentes interceptos (ecuación Michael mendel indica la velocidad para diferentes concentración de sustrato) y estos dependen del Km. El reciproco del Km pero con signo cambiado (eje x negativo), entonces si a este intercepto le cambia el signo y se le saca el reciproco se obtiene el Km. entonces en la inhibición competitiva la velocidad máxima no cambia, lo q cambia es l Km. Un inhibidor competitivo no hace cambiar la velocidad máxima porque, para tener velocidad máxima se extrapola y tenemos concentración de sustrato infinita, por lo tanto no hay enzima libre, y por lo tanto el inhibidor nunca se podrá unir a la enzima. Entonces no pudiéndose unir la velocidad es la misma todo el rato, haya o no inhibidor. Solo es afectado el Km, a mayor concentración de inhibidor mayor es el Km.
2º Aquí no ay competencia, el inhibidor se une a un sitio diferente. Aquí el inhibidor afecta tanto a ala velocidad máxima como a él Km porque los interceptos son todos diferentes, tiene que afectar la velocidad máxima porque como no compiten por el mismo sitio no es posible desplazar al inhibidor aumentando la concentración del sustrato. A mayor concentración de inhibidor de tipo mixto la velocidad máxima disminuye y aumenta el Km.
3º Es poco común que el inhibidor solo se pueda unirse al complejo ES.
4º Que sea no competitiva es mas poco común y aquí la velocidad máxima disminuye con la concentración de inhibidor y el km no es afectado.















0 comentarios:
Publicar un comentario